Key Takeaways:
- পদার্থের তিনটি প্রধান অবস্থা, কঠিন, তরল ও গ্যাসীয়, তাদের বৈশিষ্ট্য এবং অণু-পরমাণুর বিন্যাস সম্পর্কে জানুন।
- তাপমাত্রা ও চাপের প্রভাবে পদার্থের অবস্থার পরিবর্তন কীভাবে ঘটে, তা বুঝুন।
- গলনাঙ্ক, স্ফুটনাঙ্ক, বাষ্পীভবন, ঘনীভবন, ও ঊর্ধ্বপাতনের মতো প্রক্রিয়াগুলো সম্পর্কে স্পষ্ট ধারণা লাভ করুন।
- আমাদের দৈনন্দিন জীবনে পদার্থের বিভিন্ন অবস্থার গুরুত্ব এবং ব্যবহারিক প্রয়োগ সম্পর্কে জানুন।
- রসায়নের এই মৌলিক ধারণাগুলো আপনার উচ্চশিক্ষার ভিত্তি তৈরি করবে।
রসায়ন বিষয়টি অনেকের কাছেই কঠিন মনে হতে পারে, কিন্তু এর মূল বিষয়গুলো যদি আপনি ভালোভাবে বুঝতে পারেন, তাহলে এটি আপনার জন্য খুবই আকর্ষণীয় হয়ে উঠবে। আজ আমরা রসায়ন অধ্যায় ২ – পদার্থের অবস্থা নিয়ে আলোচনা করব, যা রসায়নের অন্যতম মৌলিক এবং গুরুত্বপূর্ণ একটি অংশ। এই অধ্যায়টি আপনাকে পদার্থের গঠন, বৈশিষ্ট্য এবং তাদের অবস্থার পরিবর্তন সম্পর্কে একটি পরিষ্কার ধারণা দেবে। আপনি কি কখনো ভেবে দেখেছেন, কেন পানি কখনো বরফ হয়, আবার কখনো বাষ্পে পরিণত হয়? এই অধ্যায়টি আপনাকে সেই কৌতূহলের উত্তর দেবে।
পদার্থ কী
আমাদের চারপাশে যা কিছু আছে, যার ওজন আছে এবং যা জায়গা দখল করে, তাকেই পদার্থ বলে। আপনার হাতে থাকা মোবাইল ফোন, আপনি যে চেয়ারে বসে আছেন, এমনকি আপনার নিঃশ্বাসের বাতাস — সবই পদার্থ। সহজ কথায়, মহাবিশ্বের সবকিছুই পদার্থ দিয়ে তৈরি।
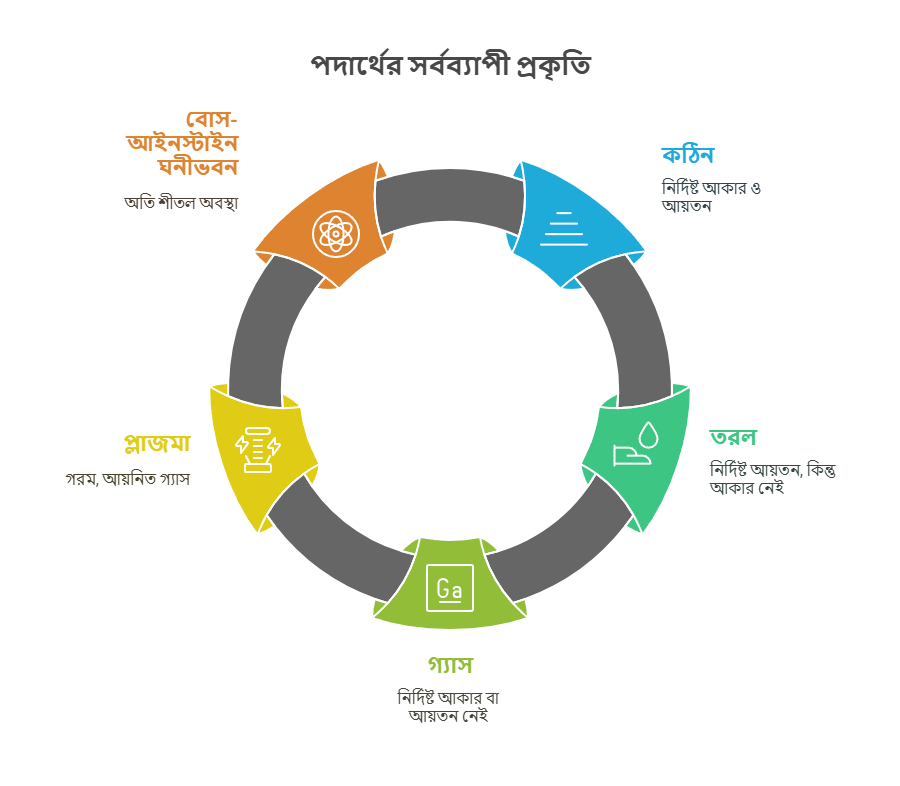
পদার্থ কেন বিভিন্ন অবস্থায় থাকে
পদার্থের কণাগুলো (পরমাণু বা অণু) কীভাবে একে অপরের সাথে যুক্ত থাকে এবং তাদের মধ্যে আকর্ষণ শক্তি কেমন, তার ওপর নির্ভর করে পদার্থ বিভিন্ন অবস্থায় থাকে। এই কণাগুলোর গতিশক্তি এবং আন্তঃআণবিক আকর্ষণ শক্তিই পদার্থের অবস্থা নির্ধারণ করে। যেমন, যখন কণাগুলো খুব কাছাকাছি থাকে এবং তাদের মধ্যে আকর্ষণ শক্তি অনেক বেশি হয়, তখন পদার্থ কঠিন অবস্থায় থাকে। আবার, যখন কণাগুলো দূরে দূরে থাকে এবং তাদের মধ্যে আকর্ষণ শক্তি কম হয়, তখন পদার্থ গ্যাসীয় অবস্থায় থাকে।
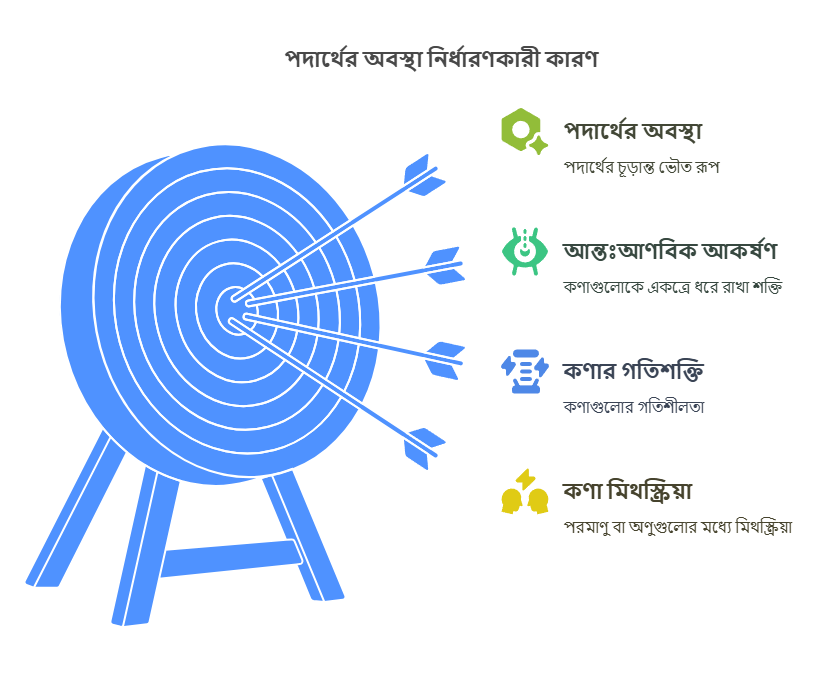
আমাদের জীবনে পদার্থের অবস্থার গুরুত্ব
পদার্থের বিভিন্ন অবস্থা আমাদের দৈনন্দিন জীবনে অপরিহার্য। পানি ছাড়া আমাদের জীবন অচল, আর পানি তার তরল অবস্থায় আমাদের পান করা, ধোয়ামোছা, রান্নার কাজে ব্যবহৃত হয়। বরফ (কঠিন পানি) ঠান্ডা করার কাজে লাগে, আর জলীয় বাষ্প (গ্যাসীয় পানি) মেঘ ও বৃষ্টির মাধ্যমে প্রাকৃতিক ভারসাম্য বজায় রাখে। শিল্পকারখানায়, চিকিৎসাবিজ্ঞানে, এমনকি মহাকাশ গবেষণাতেও পদার্থের বিভিন্ন অবস্থার জ্ঞান অত্যন্ত গুরুত্বপূর্ণ।
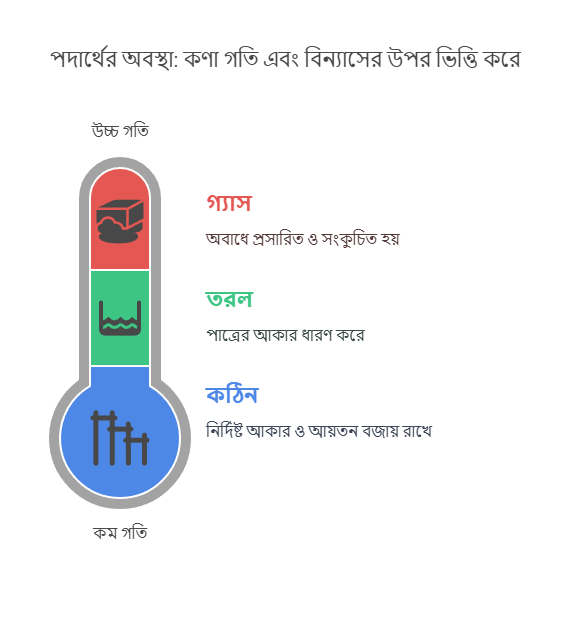
পদার্থের প্রধান তিনটি অবস্থা
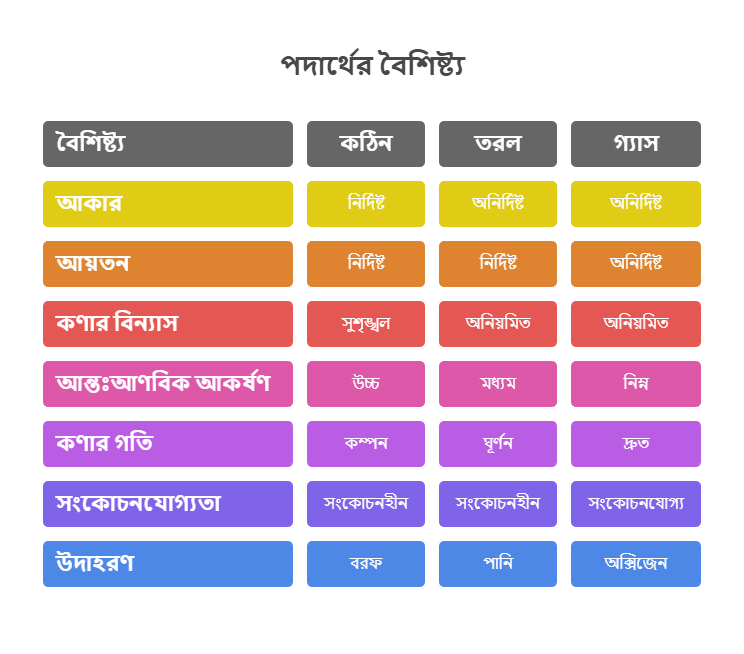
পদার্থের প্রধানত তিনটি অবস্থা রয়েছে: কঠিন (Solid), তরল (Liquid) এবং গ্যাসীয় (Gas)। প্রতিটি অবস্থারই নিজস্ব কিছু বৈশিষ্ট্য আছে, যা তাদের একে অপরের থেকে আলাদা করে।
কঠিন (Solid)
কঠিন পদার্থের একটি নির্দিষ্ট আকার এবং আয়তন আছে। আপনি যদি একটি পাথর হাতে নেন, দেখবেন তার আকার কখনোই পরিবর্তিত হচ্ছে না, এবং সে একটি নির্দিষ্ট পরিমাণ জায়গা দখল করে আছে।
নির্দিষ্ট আকার ও আয়তন
কঠিন পদার্থের কণাগুলো খুব কাছাকাছি এবং সুনির্দিষ্ট অবস্থানে থাকে। এর কারণ হলো তাদের মধ্যেকার আন্তঃআণবিক আকর্ষণ শক্তি অনেক বেশি। এই শক্তিশালী আকর্ষণ বলের কারণে কণাগুলো তাদের নির্দিষ্ট অবস্থান থেকে সহজে নড়াচড়া করতে পারে না।
কণাগুলো ঘনভাবে ও সুশৃঙ্খলভাবে বিন্যস্ত
কঠিন পদার্থের কণাগুলো একটি নির্দিষ্ট জ্যামিতিক প্যাটার্নে সুশৃঙ্খলভাবে সাজানো থাকে। এই বিন্যাসকে বলা হয় কেলাস গঠন (Crystal Lattice)। যেমন, লবণের দানা বা চিনির দানা – এগুলোতে কণাগুলো একটি নির্দিষ্ট নিয়মে সাজানো থাকে।
কণাগুলোর গতি কম থাকে
কঠিন পদার্থের কণাগুলো তাদের নির্দিষ্ট অবস্থানে থেকেই কেবল কম্পন করতে পারে। তারা এক জায়গা থেকে অন্য জায়গায় চলাচল করতে পারে না। এ কারণেই কঠিন পদার্থগুলো দৃঢ় এবং অনমনীয় হয়।
তরল (Liquid)
তরল পদার্থের নির্দিষ্ট আয়তন আছে, কিন্তু নির্দিষ্ট আকার নেই। যেমন, এক গ্লাস পানি একটি পাত্রে রাখলে সেটি সেই পাত্রের আকার ধারণ করে।

নির্দিষ্ট আয়তন, কিন্তু নির্দিষ্ট আকার নেই
তরল পদার্থের কণাগুলোর মধ্যে আন্তঃআণবিক আকর্ষণ শক্তি কঠিন পদার্থের তুলনায় কিছুটা কম থাকে। ফলে কণাগুলো নির্দিষ্ট স্থানে আবদ্ধ থাকে না, বরং একে অপরের ওপর দিয়ে গড়িয়ে চলতে পারে। এ কারণেই তরল পদার্থ যে পাত্রে রাখা হয়, সেই পাত্রের আকার ধারণ করে।
পাত্র অনুযায়ী আকার নেয়
পানি, তেল, দুধ – সবই তরল পদার্থ। আপনি যখন এগুলিকে গ্লাস, বাটি বা বোতলে রাখবেন, তখন তারা সেই পাত্রের আকার নেবে। কিন্তু তাদের আয়তন একই থাকবে।
কণাগুলো গড়িয়ে চলে এবং তুলনামূলকভাবে বেশি গতি সম্পন্ন
তরল পদার্থের কণাগুলো কঠিনের চেয়ে বেশি গতিশীল। তারা একে অপরের পাশ দিয়ে অবাধে চলাচল করতে পারে, কিন্তু তাদের মধ্যেকার আকর্ষণ শক্তি এত বেশি থাকে যে তারা একে অপরের থেকে সম্পূর্ণ বিচ্ছিন্ন হয়ে যেতে পারে না। এ কারণেই তরল পদার্থের পৃষ্ঠটান (Surface tension) এবং সান্দ্রতা (Viscosity) দেখা যায়।
গ্যাস (Gas)
গ্যাসীয় পদার্থের নির্দিষ্ট আকার বা আয়তন কোনোটাই নেই। একটি বেলুনে গ্যাস ভরলে সেটি বেলুনের পুরো স্থান জুড়ে ছড়িয়ে পড়ে।
নির্দিষ্ট আকার ও আয়তন নেই
গ্যাসীয় পদার্থের কণাগুলোর মধ্যে আন্তঃআণবিক আকর্ষণ শক্তি খুবই কম, প্রায় নেই বললেই চলে। ফলে কণাগুলো একে অপরের থেকে অনেক দূরে দূরে থাকে এবং স্বাধীনভাবে চলাচল করতে পারে।
কণাগুলো অনেক দূরে দূরে থাকে
গ্যাসীয় কণাগুলো এতটাই দূরে থাকে যে তাদের মধ্যে কোনো নির্দিষ্ট বিন্যাস থাকে না। তারা দ্রুত গতিতে এলোমেলোভাবে চলাচল করে এবং একে অপরের সাথে ও পাত্রের দেয়ালের সাথে ধাক্কা খায়।
কণাগুলোর গতি সবচেয়ে বেশি
গ্যাসীয় কণাগুলোর গতিশক্তি কঠিন ও তরল পদার্থের কণার চেয়ে অনেক বেশি। তারা খুব দ্রুত এক স্থান থেকে অন্য স্থানে ছড়িয়ে পড়তে পারে, যাকে ব্যাপন (Diffusion) বলে। এ কারণেই পারফিউমের গন্ধ ঘরের এক কোণ থেকে অন্য কোণে দ্রুত ছড়িয়ে পড়ে।
অন্যান্য অবস্থা (উচ্চতর জ্ঞান)
পদার্থের প্রধান তিনটি অবস্থা ছাড়াও আরও কিছু অবস্থা রয়েছে, যা সাধারণত উচ্চ তাপমাত্রায় বা অত্যন্ত নিম্ন তাপমাত্রায় দেখা যায়। এগুলোকে পদার্থের চতুর্থ বা পঞ্চম অবস্থা বলা হয়।
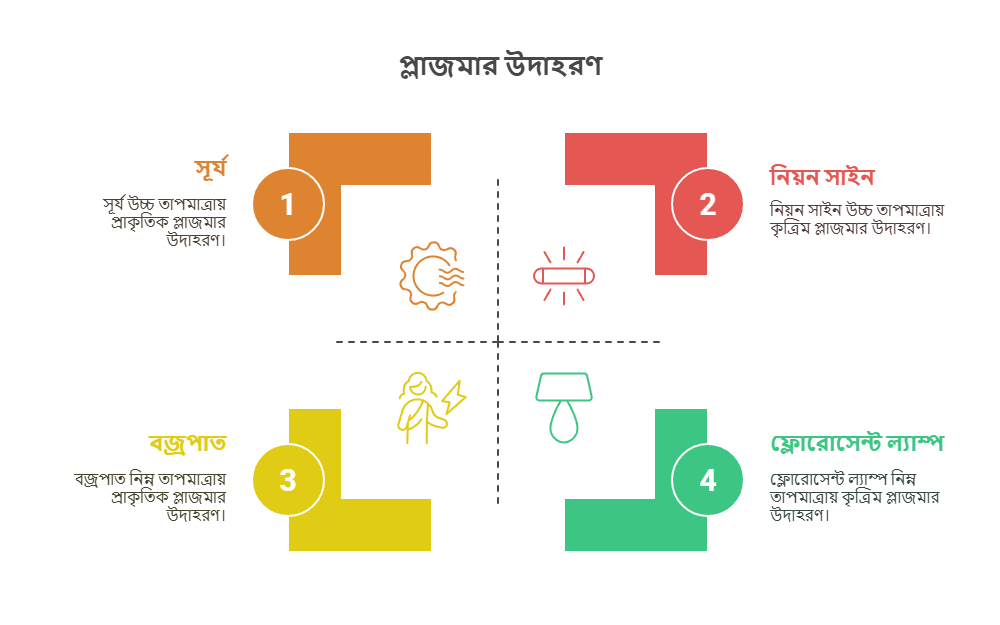
প্লাজমা: গরম গ্যাসীয় পদার্থ যা ইলেকট্রন মুক্ত করে
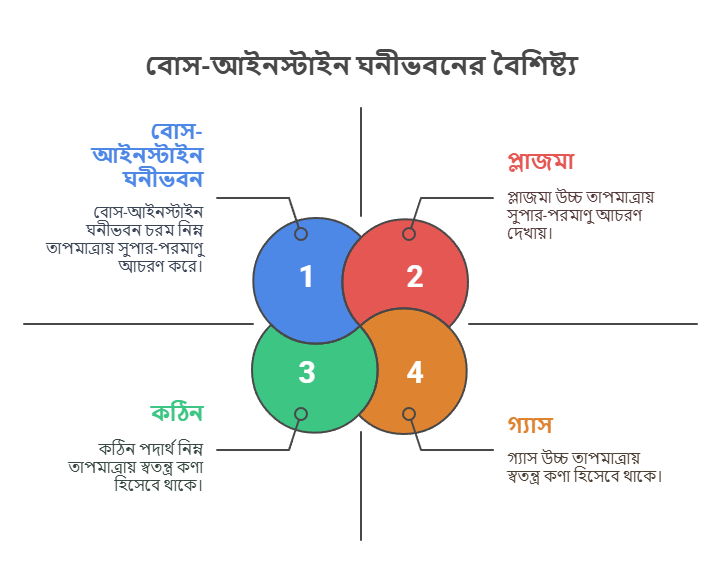
প্লাজমা হলো পদার্থের চতুর্থ অবস্থা। এটি উচ্চ তাপমাত্রায় তৈরি হয়, যখন গ্যাসকে এত বেশি তাপ দেওয়া হয় যে এর পরমাণুগুলো তাদের ইলেকট্রন হারিয়ে আয়নে পরিণত হয়। অর্থাৎ, প্লাজমা হলো আয়নিত গ্যাস, যেখানে মুক্ত ইলেকট্রন এবং আয়নিত পরমাণু থাকে। মহাবিশ্বের প্রায় ৯৯% পদার্থই প্লাজমা অবস্থায় আছে, যেমন – সূর্য, নক্ষত্র এবং বজ্রপাতের সময় সৃষ্ট বিদ্যুৎ স্ফুলিঙ্গ। ফ্লোরোসেন্ট ল্যাম্প এবং নিয়ন সাইনেও প্লাজমা ব্যবহৃত হয়।
বোস-আইনস্টাইন ঘনীভবন: খুবই নিম্ন তাপমাত্রায় গঠিত পদার্থের অবস্থা
বোস-আইনস্টাইন ঘনীভবন (Bose-Einstein Condensate – BEC) হলো পদার্থের পঞ্চম অবস্থা। এটি চরম নিম্ন তাপমাত্রায় (পরম শূন্য তাপমাত্রার খুব কাছাকাছি, প্রায় -২৭৩.১৫° সেলসিয়াস) তৈরি হয়, যখন কিছু নির্দিষ্ট ধরনের পরমাণুকে (বোসন) ঠান্ডা করা হয়। এই অবস্থায় পরমাণুগুলো তাদের স্বতন্ত্র পরিচয় হারিয়ে একটি একক “সুপার-পরমাণু”র মতো আচরণ করে। এই অবস্থাটি বিজ্ঞানী সত্যেন্দ্রনাথ বোস এবং আলবার্ট আইনস্টাইন ভবিষ্যদ্বাণী করেছিলেন। এটি সুপারফ্লুইডিটি এবং কোয়ান্টাম মেকানিক্সের গবেষণায় গুরুত্বপূর্ণ ভূমিকা রাখে।
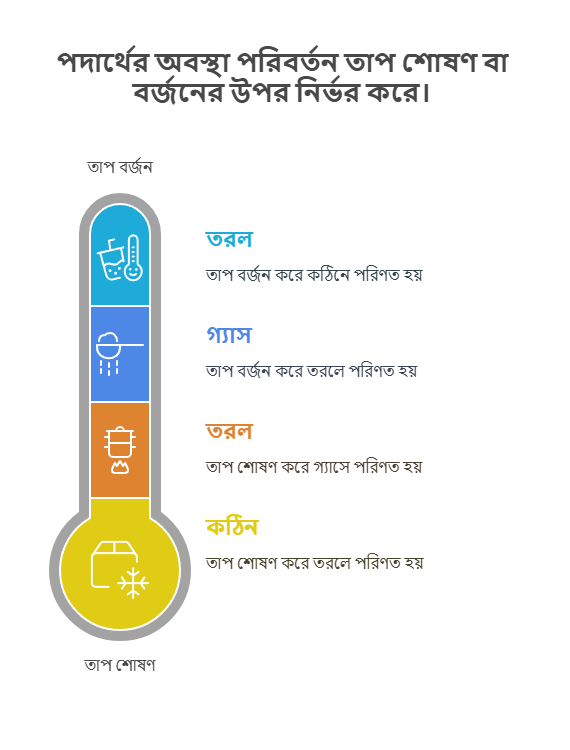
পদার্থের অবস্থা পরিবর্তন
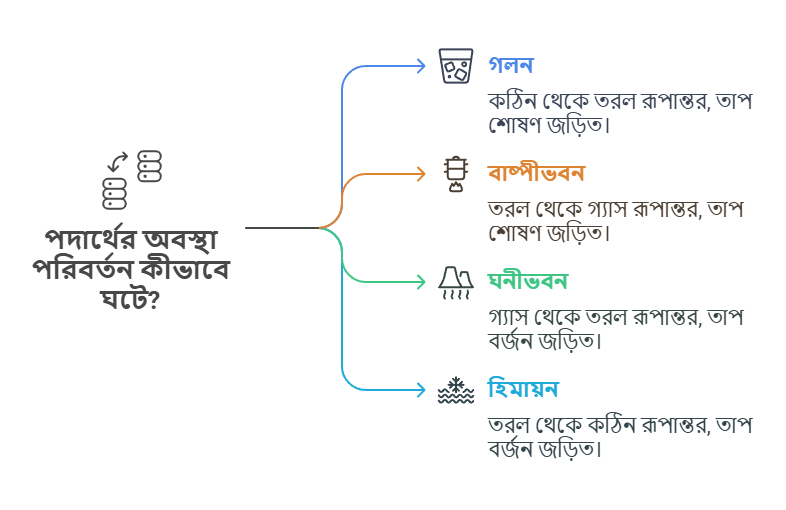
পদার্থের এক অবস্থা থেকে অন্য অবস্থায় রূপান্তরকে পদার্থের অবস্থা পরিবর্তন বলে। এই পরিবর্তন সাধারণত তাপমাত্রা বা চাপের পরিবর্তনের কারণে ঘটে। এই প্রক্রিয়াগুলোর মধ্যে তাপশক্তি গ্রহণ বা বর্জন জড়িত থাকে।
গলন: ঠোস → তরল
যখন একটি কঠিন পদার্থ তাপশক্তি শোষণ করে তরল অবস্থায় রূপান্তরিত হয়, তাকে গলন বলে। যেমন, বরফ তাপ শোষণ করে পানিতে পরিণত হয়।
বাষ্পীভবন: তরল → গ্যাস
যখন একটি তরল পদার্থ তাপশক্তি শোষণ করে গ্যাসীয় অবস্থায় রূপান্তরিত হয়, তাকে বাষ্পীভবন বলে। যেমন, পানিকে তাপ দিলে তা জলীয় বাষ্পে পরিণত হয়।
ঘনীভবন: গ্যাস → তরল
যখন একটি গ্যাসীয় পদার্থ তাপশক্তি বর্জন করে তরল অবস্থায় রূপান্তরিত হয়, তাকে ঘনীভবন বলে। যেমন, ঠান্ডা গ্লাসের বাইরে জলীয় বাষ্প জমে পানির ফোঁটা তৈরি হয়।
হিমায়ন: তরল → ঠোস
যখন একটি তরল পদার্থ তাপশক্তি বর্জন করে কঠিন অবস্থায় রূপান্তরিত হয়, তাকে হিমায়ন বা জমাট বাঁধা বলে। যেমন, পানিকে ফ্রিজে রাখলে তা বরফে পরিণত হয়।
গলনাঙ্ক ও স্ফুটনাঙ্কের ধারণা
- গলনাঙ্ক (Melting Point): যে নির্দিষ্ট তাপমাত্রায় কোনো কঠিন পদার্থ তরলে রূপান্তরিত হয়, তাকে সেই পদার্থের গলনাঙ্ক বলে। বিশুদ্ধ পদার্থের গলনাঙ্ক একটি নির্দিষ্ট তাপমাত্রা হয়। যেমন, বরফের গলনাঙ্ক ০° সেলসিয়াস।
- স্ফুটনাঙ্ক (Boiling Point): যে নির্দিষ্ট তাপমাত্রায় কোনো তরল পদার্থ গ্যাসীয় অবস্থায় রূপান্তরিত হয়, তাকে সেই পদার্থের স্ফুটনাঙ্ক বলে। বিশুদ্ধ পদার্থের স্ফুটনাঙ্কও একটি নির্দিষ্ট তাপমাত্রা হয়। যেমন, পানির স্ফুটনাঙ্ক ১০০° সেলসিয়াস।
তাপের প্রভাব ও শক্তির বিনিময়
পদার্থের অবস্থা পরিবর্তনের জন্য তাপশক্তি অত্যন্ত গুরুত্বপূর্ণ। কঠিন থেকে তরল বা তরল থেকে গ্যাসীয় অবস্থায় যেতে পদার্থকে তাপ শোষণ করতে হয় (লীন তাপ), এবং গ্যাসীয় থেকে তরল বা তরল থেকে কঠিন অবস্থায় আসতে পদার্থকে তাপ বর্জন করতে হয়। এই লীন তাপ (Latent Heat) পদার্থের তাপমাত্রা না বাড়িয়ে তার অবস্থা পরিবর্তন করে।
পদার্থের অবস্থা পরিবর্তনের ফ্লোচার্ট
কঠিন (Solid)
↓ (গলন / Melting – তাপ গ্রহণ)
তরল (Liquid)
↓ (বাষ্পীভবন / Vaporization – তাপ গ্রহণ)
গ্যাস (Gas)
↑ (ঘনীভবন / Condensation – তাপ বর্জন)
তরল (Liquid)
↑ (হিমায়ন / Freezing – তাপ বর্জন)
কঠিন (Solid)
এছাড়াও, কঠিন থেকে সরাসরি গ্যাসে এবং গ্যাস থেকে সরাসরি কঠিনে রূপান্তর হতে পারে, যাকে ঊর্ধ্বপাতন (Sublimation) বলে।
ঊর্ধ্বপাতন: কঠিন → গ্যাস
কিছু কিছু কঠিন পদার্থ আছে, যারা তাপ দিলে সরাসরি গ্যাসীয় অবস্থায় রূপান্তরিত হয়, তরল অবস্থায় যায় না। এই প্রক্রিয়াকে ঊর্ধ্বপাতন বলে। যেমন, কর্পূর, ন্যাপথালিন, শুষ্ক বরফ (কঠিন কার্বন ডাই অক্সাইড) হলো ঊর্ধ্বপাতিত পদার্থ।
গ্যাসের ধর্ম
গ্যাসীয় পদার্থের কণাগুলোর মধ্যেকার দুর্বল আকর্ষণ এবং উচ্চ গতিশক্তির কারণে তাদের কিছু বিশেষ ধর্ম রয়েছে।
বয়েলস সূত্র: চাপ ও আয়তনের সম্পর্ক
বয়েলের সূত্র অনুসারে, স্থির তাপমাত্রায় কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন তার চাপের ব্যস্তানুপাতিক। অর্থাৎ, তাপমাত্রা স্থির রেখে গ্যাসের চাপ বাড়ালে আয়তন কমে, এবং চাপ কমালে আয়তন বাড়ে।
$$P \propto \frac{1}{V} \quad \text{বা} \quad PV = \text{ধ্রুবক}$$
এখানে, P = চাপ, V = আয়তন।
চার্লস সূত্র: তাপমাত্রা ও আয়তনের সম্পর্ক
চার্লসের সূত্র অনুসারে, স্থির চাপে কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন তার পরম তাপমাত্রার সমানুপাতিক। অর্থাৎ, চাপ স্থির রেখে গ্যাসের তাপমাত্রা বাড়ালে আয়তন বাড়ে, এবং তাপমাত্রা কমালে আয়তন কমে।
$$V \propto T \quad \text{বা} \quad \frac{V}{T} = \text{ধ্রুবক}$$
এখানে, V = আয়তন, T = পরম তাপমাত্রা (কেলভিন স্কেলে)।
বাস্তব জীবনের উদাহরণ
- বয়েলসের সূত্র: সাইকেলের টায়ারে বাতাস ঢোকানোর সময় পাম্পের ভেতরের বাতাস সংকুচিত হয় (আয়তন কমে), ফলে চাপ বাড়ে। আবার, সমুদ্রের গভীরে থাকা গ্যাসের বুদবুদ যখন ওপরের দিকে ওঠে, তখন চাপ কমে যাওয়ায় তার আয়তন বাড়ে।
- চার্লসের সূত্র: শীতকালে ফুটবল বা বাস্কেটবলের ভেতরের বাতাস সংকুচিত হয়ে যায় (আয়তন কমে), কারণ তাপমাত্রা কমে যায়। আবার, গরমকালে টায়ারের বাতাস গরম হয়ে প্রসারিত হয় (আয়তন বাড়ে)।
গ্যাস কণার চাপ প্রয়োগের ব্যাখ্যা
গ্যাস কণাগুলো এলোমেলোভাবে প্রচণ্ড গতিতে চলাচল করে এবং পাত্রের ভেতরের দেয়ালের সাথে অবিরাম ধাক্কা খায়। এই ধাক্কাগুলোর সমষ্টিই পাত্রের দেয়ালের ওপর চাপ সৃষ্টি করে। যত বেশি কণা থাকবে বা কণাগুলোর গতি যত বেশি হবে, তত বেশি ধাক্কা লাগবে এবং চাপ তত বেশি হবে।
গুরুত্বপূর্ণ সূত্র ও চিত্র
রসায়নে পদার্থের অবস্থা অধ্যায়টি ভালোভাবে বোঝার জন্য কিছু মৌলিক সংজ্ঞা এবং সূত্র মনে রাখা জরুরি।
পদার্থের অবস্থা পরিবর্তনের flowchart
এটি আগেই আলোচনা করা হয়েছে। এই ফ্লোচার্টটি আপনাকে পদার্থের অবস্থা পরিবর্তনের প্রক্রিয়াগুলো সহজে মনে রাখতে সাহায্য করবে।
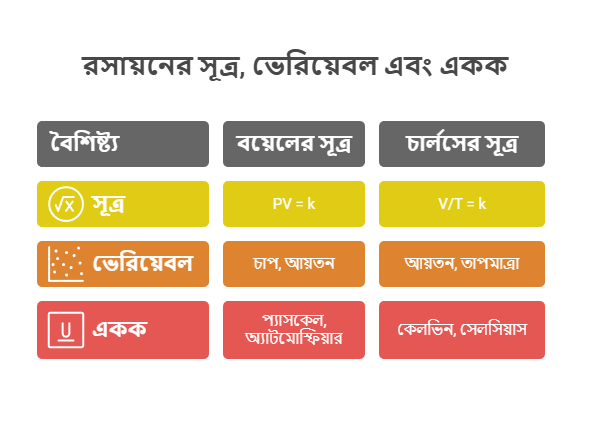
সূত্রের তালিকা ও একক
| সূত্র | গাণিতিক রূপ | ধ্রুবক |
|---|---|---|
| বয়েলের সূত্র | $PV = k$ | তাপমাত্রা |
| চার্লসের সূত্র | $V/T = k$ | চাপ |
একক:
- চাপ (P): প্যাসকেল (Pa), অ্যাটমোস্ফিয়ার (atm), মিলিমিটার পারদ (mmHg)
- আয়তন (V): ঘনমিটার (m³), লিটার (L), মিলিলিটার (mL)
- তাপমাত্রা (T): কেলভিন (K), সেলসিয়াস (°C)
পরীক্ষার প্রস্তুতির জন্য গুরুত্বপূর্ণ প্রশ্ন
রসায়ন অধ্যায় ২ থেকে পরীক্ষায় কী ধরনের প্রশ্ন আসতে পারে, তা জেনে রাখা আপনার প্রস্তুতির জন্য খুবই সহায়ক হবে।
বহু নির্বাচনী প্রশ্ন (MCQ):
১. গলনাঙ্ক কী?
ক) যে তাপমাত্রায় তরল গ্যাস হয়
খ) যে তাপমাত্রায় কঠিন তরল হয়
গ) যে তাপমাত্রায় গ্যাস তরল হয়
ঘ) যে তাপমাত্রায় তরল কঠিন হয়
২. কণার বিন্যাসের ভিত্তিতে কোনটি সঠিক?
ক) কঠিন: এলোমেলো, তরল: সুশৃঙ্খল, গ্যাস: ঘনসন্নিবিষ্ট
খ) কঠিন: সুশৃঙ্খল, তরল: অনিয়মিত, গ্যাস: বিক্ষিপ্ত
গ) কঠিন: বিক্ষিপ্ত, তরল: সুশৃঙ্খল, গ্যাস: এলোমেলো
ঘ) কঠিন: ঘনসন্নিবিষ্ট, তরল: বিক্ষিপ্ত, গ্যাস: সুশৃঙ্খল
সৃজনশীল প্রশ্ন (CQ):
১. পদার্থের তিনটি অবস্থা ব্যাখ্যা কর।
এই প্রশ্নের উত্তরে আপনাকে কঠিন, তরল ও গ্যাসীয় পদার্থের সংজ্ঞা, বৈশিষ্ট্য, কণার বিন্যাস এবং আন্তঃআণবিক আকর্ষণ শক্তি সম্পর্কে বিস্তারিত লিখতে হবে।
২. পদার্থের অবস্থা পরিবর্তনের বিভিন্ন প্রক্রিয়া লেখ।
এই প্রশ্নের উত্তরে আপনাকে গলন, বাষ্পীভবন, ঘনীভবন, হিমায়ন এবং ঊর্ধ্বপাতন প্রক্রিয়াগুলো ব্যাখ্যা করতে হবে। প্রতিটি প্রক্রিয়ার সংজ্ঞা, তাপের প্রভাব এবং উদাহরণ দিতে হবে।
আপনার পরীক্ষার প্রস্তুতি আরও ভালোভাবে নিতে আপনি ১০ মিনিট স্কুলের অনলাইন ব্যাচগুলোতে যোগদান করতে পারেন। বিশেষ করে নবম ও দশম শ্রেণির রসায়ন শিক্ষার্থীদের জন্য SSC রসায়ন নোট PDF এবং SSC রসায়ন ৫ম অধ্যায় নোটগুলো খুবই সহায়ক হবে।
মনে রাখার টিপস
রসায়নের এই অধ্যায়টি মনে রাখার জন্য কিছু সহজ কৌশল অবলম্বন করতে পারেন:
- “ঠোস → তরল → গ্যাস” এই ধারাবাহিকতা মনে রাখা: পদার্থের অবস্থার পরিবর্তনগুলো এই সহজ ক্রম অনুযায়ী চিন্তা করলে মনে রাখা সহজ হবে। প্রতিটি ধাপে তাপ গ্রহণ বা বর্জনের বিষয়টিও মনে রাখবেন।
- চার্ট ও চিত্র দেখে অনুশীলন করা: কঠিন, তরল ও গ্যাসীয় পদার্থের কণার বিন্যাসের চিত্রগুলো বারবার দেখুন এবং নিজে আঁকার চেষ্টা করুন। এতে আপনার visual memory শক্তিশালী হবে। উপরে দেওয়া টেবিলটি মুখস্থ করুন।
- সূত্র ও সংজ্ঞাগুলো বারবার পড়া: বয়েলের সূত্র, চার্লসের সূত্র, গলনাঙ্ক, স্ফুটনাঙ্ক – এই সংজ্ঞাগুলো এবং তাদের গাণিতিক রূপগুলো নিয়মিত অনুশীলন করুন। ছোট ছোট ফ্ল্যাশকার্ড তৈরি করে পড়তে পারেন।
- বাস্তব জীবনের উদাহরণ: আপনার চারপাশে পদার্থের বিভিন্ন অবস্থার উদাহরণগুলো খেয়াল করুন। যেমন, চা তৈরি করার সময় পানির বাষ্পীভবন, বরফ গলে যাওয়া, পারফিউমের গন্ধ ছড়ানো – এগুলো আপনাকে ধারণাগুলো আরও ভালোভাবে বুঝতে সাহায্য করবে।
শর্টনোট / PDF ডাউনলোড
রসায়ন অধ্যায় ২ এর উপর একটি সংক্ষিপ্ত নোট বা PDF ফাইল আপনার দ্রুত রিভিশনের জন্য খুবই উপকারী হতে পারে। এই নোটগুলো আপনি ১০ মিনিট স্কুলের বিভিন্ন শিক্ষামূলক রিসোর্স থেকে সংগ্রহ করতে পারেন। বিশেষ করে রসায়ন ২য় অধ্যায় নোট বা SSC chemistry hand notes pdf bangla আপনাকে পরীক্ষার আগে দ্রুত প্রস্তুতি নিতে সাহায্য করবে।
উপসংহার
রসায়ন অধ্যায় ২ – পদার্থের অবস্থা একটি মৌলিক এবং অত্যন্ত গুরুত্বপূর্ণ অধ্যায়। এই অধ্যায়ের জ্ঞান আপনাকে রসায়নের অন্যান্য জটিল বিষয়গুলো বুঝতে সাহায্য করবে। পদার্থের তিনটি প্রধান অবস্থা – কঠিন, তরল, গ্যাসীয় – তাদের বৈশিষ্ট্য, এবং তাপ ও চাপের প্রভাবে তাদের অবস্থার পরিবর্তন সম্পর্কে একটি স্পষ্ট ধারণা থাকা অত্যাবশ্যক।
আপনি যদি এই অধ্যায়ের প্রতিটি বিষয় মনোযোগ দিয়ে পড়ে থাকেন এবং নিয়মিত অনুশীলন করেন, তাহলে রসায়নের এই অংশটি আপনার কাছে আর কঠিন মনে হবে না। আপনার যদি আরও সাহায্যের প্রয়োজন হয়, তাহলে ১০ মিনিট স্কুলের অনলাইন ব্যাচগুলোতে যুক্ত হতে পারেন, যেখানে অভিজ্ঞ শিক্ষকরা আপনাকে প্রতিটি বিষয় হাতে ধরে শেখাবেন। মনে রাখবেন, ভালো ফলাফল পেতে নিয়মিত অনুশীলনের কোনো বিকল্প নেই। আপনার রসায়ন যাত্রা শুভ হোক!